Оксиды — это сложные вещества, состоящие из двух химических элементов, одним из которых является кислород.
3 группы солеобразующих оксидов
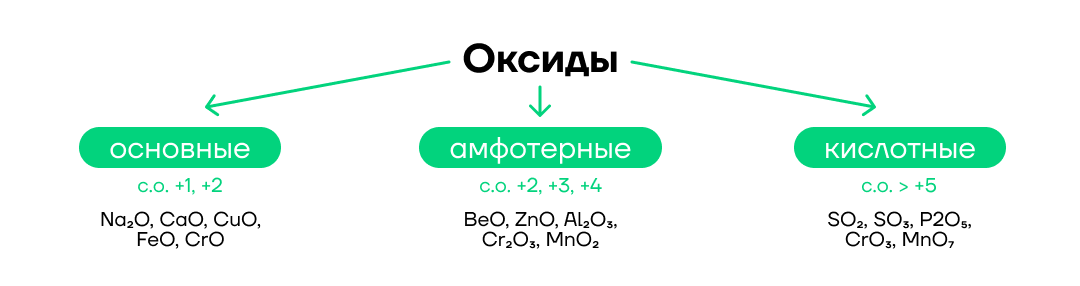
- Основные — оксиды металлов в степени окисления +1, +2 (CuO, Na₂O), кроме ZnO, BeO. Им соответствуют основные гидроксиды (основания).
- Амфотерные — оксиды металлов в степени окисления +3, +4 и ZnO, BeO, PbO. Им соответствуют амфотерные гидроксиды.
- Кислотные — оксиды неметаллов (кроме несолеобразующих CO, NO, N₂O, SiO) и металлов в степени окисления +5 и выше (SO₂, CrO₃).
Физические свойства оксидов
- Жидкие (SO₃).
- Твердые (оксиды Me, SiO₂, P₂O₅).
- Газообразные (NO, NO₂, CO, CO₂, SO₂).
Химические свойства основных оксидов
Взаимодействие с водой
Осн. оксид + вода → щелочь
Искл. : MgO + H₂O → Mg(OH)₂ (при кипячении)
Взаимодействие с кислотами
Осн. оксид + кислота → соль + вода
CuO + 2HCl -(t)→ CuCl₂ + H₂O
Взаимодействие с кислотными оксидами
К. оксид + осн. оксид → соль
Химические свойства кислотных оксидов
Взаимодействие с водой
К. оксид + вода → растворимая кислота
❗️SiO₂ с водой не взаимодействует
Взаимодействие с основаниями
К. оксид + основание → соль + вода
CO₂ + Ba(OH)₂ → BaCO₃ + H₂O
Восстановление до простых веществ
Взаимодействие с основными оксидами (см. выше)
Химические свойства амфотерных оксидов
Проявляя основные свойства — с сильными кислотами
ZnO + H₂SO₄ → ZnSO₄ + H₂O
Проявляя кислотные свойства — со щелочами
ZnO + 2NaOH -(t) → Na₂ZnO₂ + H₂O (в расплаве)
ZnO + 2NaOH + H₂O → Na₂[Zn(OH)₄] (в растворе)
С карбонатами и сульфитами при сплавлении
ZnO + Na₂CO₃ → Na₂ZnO₂ + CO₂






Может быть интересно