
Автор статьи
Бендюкевич Ксения
Преподаватель



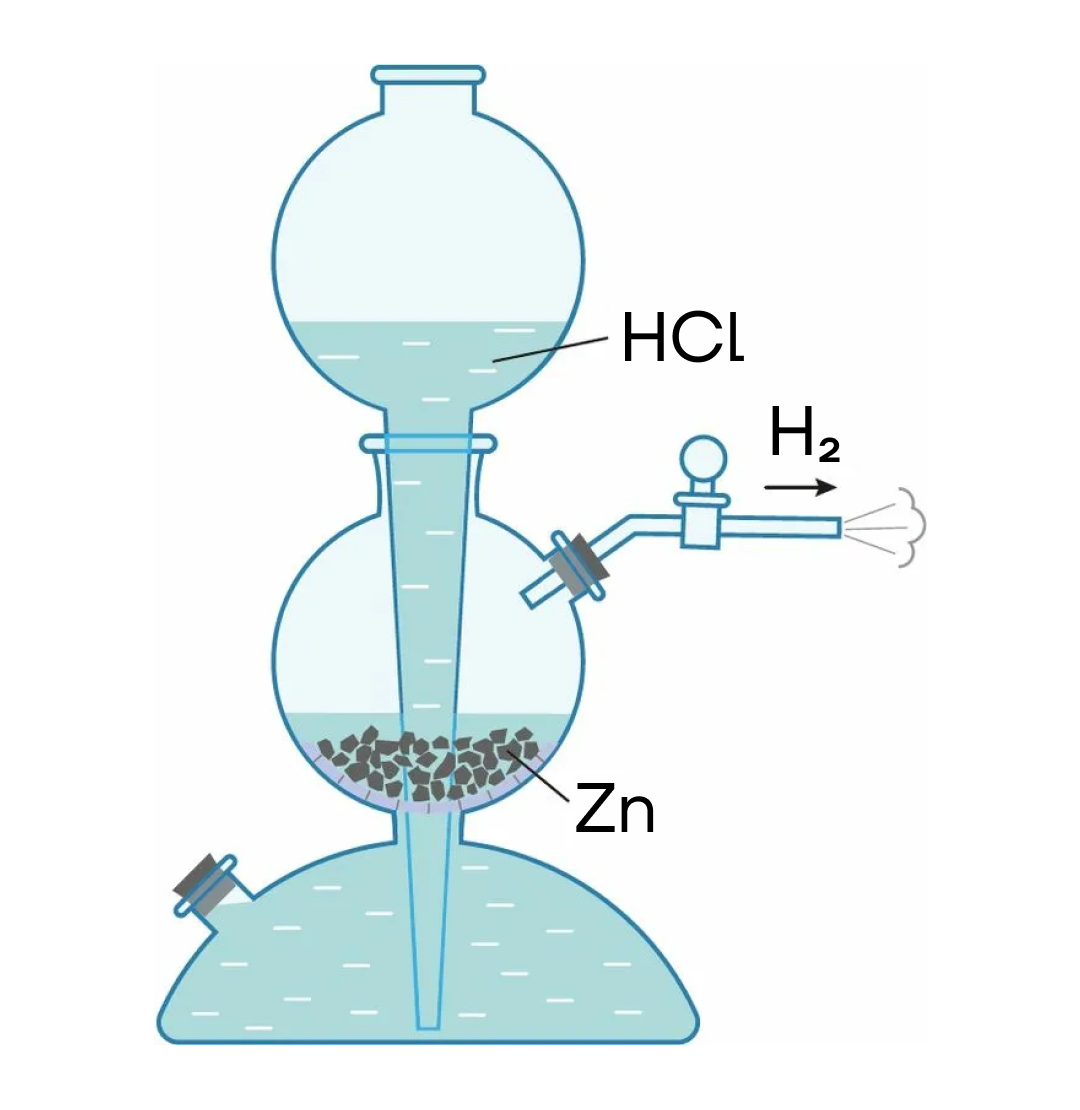
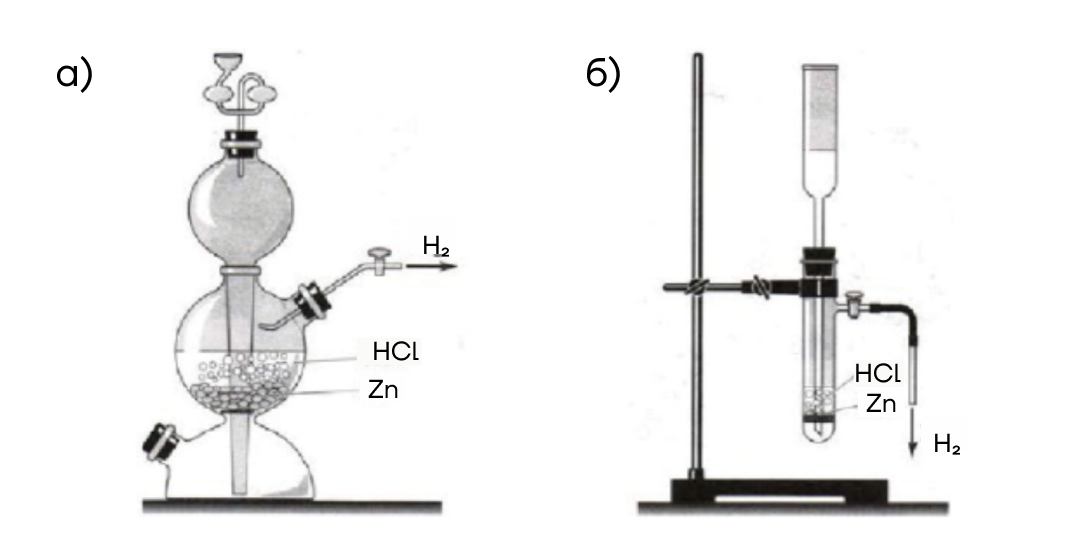
В лаборатории обычно используют реакцию кислот-неокислителей с металлами, которые в ряду активности стоят левее водорода в специальных аппаратах (например, Киппа):
Zn + 2HCl → ZnCl₂ + H₂↑
СН₄ → С + 2Н₂
СН₄ + H₂O ↔ CO + 3H₂
С + H₂O ↔ CO + H₂
2H₂O → 2H₂ + O₂
Образует гидриды при нагревании (с.о. H -1):
2Na + H₂ → 2NaH
Ca + H₂ → CaH₂
Гидриды реагируют с водой и кислотами:
NaH + H2O → NaOH + H₂↑
NaH + HCl → NaCl + H₂↑
Реагирует с оксидами металлов после Al в ряду активности при нагревании:
CuO + H₂ → Cu + H₂O
Смесь оксида углерода (II) и водорода — синтез-газ, используется при получении метанола, формальдегида и синтетический бензин на катализаторах при нагревании и давлении:
CO + 2H₂ ↔ CH₃OH
При нагревании: H₂ + S → H₂S
Горение со взрывом (гремучий газ): 2Н₂ + О₂ → 2Н₂О
На катализаторе (пористое железо), при нагревании и давлении получают аммиак:
3H₂ + N₂ ↔ 2NH₃
При повышенном давлении и температуре, на катализаторах образует углеводороды:
C + 2H₂ → CH₄
С фтором — со взрывом, с хлором/бромом — только при нагревании или облучении светом, с иодом — обратимая реакция при сильном нагревании:
H₂ + Hal₂ → 2HHal
Не реагирует с фосфором и кремнием.
Нажмите «Подписаться» и выберите удобный мессенджер или почту, чтобы получать уведомления о публикациях.

Может быть интересно